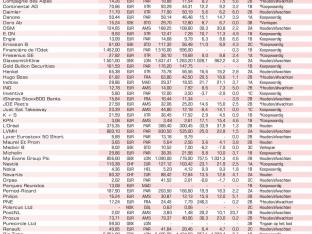
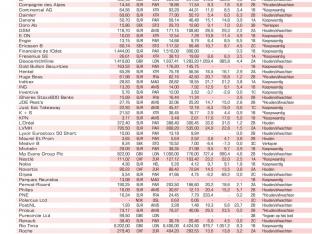
Medivir
24/10 is D-day
95,00 SEK – 3C↓
Medivir (ticker MVIRB op de beurs van Stockholm; ISIN-code SE0000273294) is een Zweeds farmaceutisch bedrijf dat het levenslicht zag in 1988, als afsplitsing van AstraZeneca, en dat sinds 1996 noteert op OMX (beurs van Stockholm). Drie kwart van de onderzoek- en ontwikkelingsactiviteiten zijn geconcentreerd op infectieziekten. Dat leidde in 2010 tot een eerste mijlpaal, met het eerste, zelf ontwikkelde middel op de markt. Xerclear/Xerese is een middel tegen koortsblaasjes. Het werd gelanceerd met partner GlaxoSmithKline (GSK), die intussen onder de namen Zoviduo en Zovirax Duo de OTC-lancering deed in Europa. De Noord-Amerikaanse rechten werden verkocht aan Meda voor 45 miljoen USD.
Er zitten nog een tiental andere projecten in de pijplijn. Centraal staan de projecten rond hepatitis C. Het is een van de meest voorkomende virale leveraandoeningen veroorzaakt door het hepatitis C-virus (HCV), ontdekt in de jaren tachtig. Hepatitis C wordt weleens de ‘stille ziekte’ of ‘stille epidemie’ genoemd, omdat de ziekte doorgaans vele jaren in het lichaam leverschade aanricht voordat er symptomen aan het licht treden. Volgens de Wereldgezondheidsorganisatie (WHO) lijden zowat 170 miljoen mensen of 3% van de wereldbevolking aan de ziekte, de meerderheid dus zonder het zelf al te weten of te beseffen. Elk jaar komen er 3 à 4 miljoen geïnfecteerden bij. Tegen 2015 zou de markt 10 miljard USD groot zijn en tegen 2025 zelfs 15 miljard USD.
Het meest geavanceerde project van Medivir in dat domein is simeprevir (TMC435), dat een gunstige fase III-studie behaalde, samen met Tibotec, het beloftevolle, Mechelse biotechbedrijf in handen van het Amerikaanse Johnson&Johnson. Hepatitis C wordt nu vooral behandeld of afgeremd met interferon en ribavirine. Simeprevir is een proteaseremmer van de tweede generatie (proteasen of peptidasen zijn enzymen die eiwitten en andere ketens van aminozuren afbreken). De fase III-resultaten gaven een bevestiging van de veiligheid en efficiëntie van de voorgaande fases: 79 tot 81% van de chronische hepatitis C-patiënten kenden een positief geneeskundig effect van de behandeling met simeprevir. In mei kreeg Medivir van de Amerikaanse Food & Drug Administration (FDA) een ‘priority review’, wat wijst op medische noodzaak. Vandaar dat de specialisten van het bedrijf op donderdag 24 oktober al de discussie mogen aangaan, met het FDA-panel, over simeprevir.
Als het panel zich duidelijk uitspreekt voor het geneesmiddel, is de kans groot dat de FDA het middel drie maanden later goedkeurt. Het geneesmiddel kan dus in 2014 al op de markt zijn. Ook de Japanse autoriteiten buigen zich momenteel over simeprevir en de beslissing daarover kan elke dag vallen. Eerder dit jaar bewees een studie met 80 patiënten, waarbij andere behandelingen hadden gefaald, dat een gecombineerde behandeling van simeprevir van Medivir met sofosbuvir van het Amerikaanse Gilead Sciences het hepatitis C-virus wist te onderdrukken. Sofosbuvir wordt in het FDA-panel 1 dag later (25/10) behandeld.
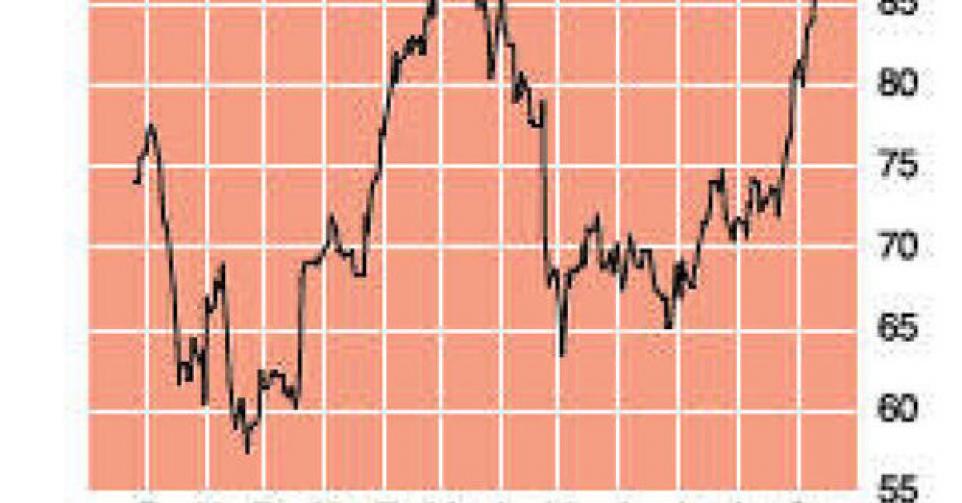
De markt heeft er vertrouwen in dat de klip in Japan en de VS wordt gerond en simeprevir op de markt komt. De koers steeg naar het hoogste peil in twee jaar en staat op 40% winst sinds het jaarbegin. Het product simeprevir zal er uiteraard goedkeuring krijgen, of geen goedkeuring. Maar de recente studies laten toch het beste vermoeden. De interferonvrije combinatietherapie zou weleens de kip met de gouden eieren kunnen zijn op het gebied van hepatitis C. Na de sterke koersstijging van de jongste maanden verlagen we het advies naar ‘houden/afwachten’ (rating 3C) en nemen we het aandeel uit de ‘Inside Selectie’. Maar we zouden nog niet (volledig) winstnemen omdat de kansen op goedkeuring toch boven 50% lijken te liggen. Het blijft wel een aandeel met een meer dan gemiddeld risico.
Houden/afwachten
Aandelen Europa
Fout opgemerkt of meer nieuws? Meld het hier