17 december is D-day voor Argenx

Vrijdag 17 december staat met stip genoteerd in onze agenda. Ten laatste op die dag velt het Amerikaanse geneesmiddelenagentschap (FDA) zijn oordeel over de goedkeuringsaanvraag van ARGX-113, de FcRn-remmer efgartigimod, in de zeldzame spierziekte gegeneraliseerde myasthenia gravis (gMG).
Het belang van die beslissing voor Argenx, en bij uitbreiding voor de Belgische biotech, kan moeilijk worden overschat. Topman Tim Van Hauwermeiren gaf onlangs aan dat efgartigimod het potentieel heeft om voor een revolutie te zorgen in de behandeling van auto-immuunziekten, en zo een van de meest verkopende geneesmiddelen ooit te worden. Vooral het pijplijn-in-een-product-potentieel spreekt tot de verbeelding. Alleen al voor de vier indicaties waarvoor fase III-studies lopen (gMG, de bloedziekte ITP, de zeldzame huidziekte pemphigus vulgaris en de zeldzame spierziekte CIDP) schatten analisten de verwachte piekomzet op 5 miljard dollar.
Tegen 2025 willen de Gentenaars het product in vijftien indicaties op de markt of in klinische studies hebben. Bovendien heeft Argenx de wereldwijde verkooprechten nog in handen, met uitzondering van China (via partner Zai Lab) en nu ook Israël (via partner Medison).
Op basis van de laatste interacties met de FDA geeft Argenx aan dat alles op schema zit voor een tijdige review van alle onderdelen van het dossier, om een oordeel toe te laten tegen 17 december. Een pandemiegerelateerde vertraging zoals met bimekizumab van UCB lijkt dus niet aan de orde.
Als de goedkeuring er komt, wordt efgartigimod de eerste FcRn-remmer op de markt. Daarmee heeft Argenx mogelijk enkele jaren voorsprong op de concurrentie, waaronder UCB. Bovendien kan het de beste van de klas zijn op het gebied van werkzaamheid, veiligheid en gebruiksgemak. Dat laatste is te danken aan de keuze tussen intraveneuze of onderhuidse toediening via de technologie van Halozyme. In de eerste helft van 2022 volgen de fase III-resultaten in gMG voor de onderhuidse toedieningsvorm.
De voorbereiding voor de start van de commercialisatie zijn volop bezig. De verkoopteams in de VS (70 mensen) en Japan (24 mensen) zijn gerekruteerd. Er wordt wel gewaarschuwd voor een geleidelijke opstart van de verkoop. De analisten verwachten gemiddeld 140 miljoen dollar omzet in 2022, maar wellicht is de helft realistischer. De beslissing over het goedkeuringsdossier in Japan valt in het eerste kwartaal van 2022, Europa is in de tweede jaarhelft aan de beurt.
De komende maanden starten fase II-/III-studies in de vijfde (de neuromusculaire ziekte myositis) en zesde (de huidziekte bullous pemphigoid) indicatie van efgartigimod, en de eerste fase II-studie met ARGX-117 (in de neurologische ziekte MMN). Ook ARGX-117 heeft het potentieel uit te groeien tot een pijplijn-in-een-product. In de eerste helft van 2022 krijgen we resultaten van de eerste van twee fase III-studies (intraveneus) met efgartigimod in ITP.
Conclusie
Het aandeel van Argenx veerde na de kwartaalupdate op. De voorafgaande zwakke weken maakten duidelijk dat er nog behoorlijk wat twijfel is over de goedkeuring van efgartigimod. Een positieve beslissing kan een enorme opkikker geven aan de Belgische biotech, gezien het unieke potentieel van de molecule. Een garantie op commercieel succes is het niet, maar we zien bovengemiddelde slaagkansen. Dat zou een primeur zijn voor een Belgisch biotechbedrijf, die nog een enorme waardecreatie kan genereren. We verhogen opnieuw het advies omdat we uitgaan van een positieve beslissing.
Advies: koopwaardig
Risico: hoog
Rating: 1C
Koers: 261,1 euro
Ticker: ARGX BB
ISIN-code: NL0010832176
Markt: Euronext Brussel
Beurskapitalisatie: 13,3 miljard euro
K/w 2020: –
Verwachte k/w 2021: –
Koersverschil 12 maanden: +22%
Koersverschil sinds jaarbegin: +7%
Dividendrendement: –
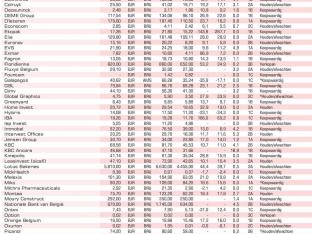
Aandelen België
Fout opgemerkt of meer nieuws? Meld het hier