Bone Therapeutics bevestigt potentieel
De resultaten van de fase IIa-studie met ALLOB waren positief. Er is geduld nodig, maar we zijn gesterkt in ons geloof in de slaagkansen van Bone Therapeutics.
Goede resultaten van de fase IIa-studie met ALLOB voor de indicatie lumbale fusie waren cruciaal voor het Waalse biotechbedrijf Bone Therapeutics, na het onverwachts stopzetten van de fase III-studie met PREOB in osteonecrose begin november 2018. Sindsdien is het aandeel ruimschoots gehalveerd. Een tegenslag met ALLOB, het allogeen botvormende celtherapieproduct dat is gemaakt uit beenmergcellen van een gezonde vrijwilliger, zou wellicht zwaar zijn afgestraft.
Maar ALLOB stelde niet teleur. Integendeel zelfs: we kregen in september 2017 al tussentijdse resultaten van de fase IIa-studie van een eerste groep van vijftien patiënten, twaalf maanden na een lumbale fusieoperatie. Die operatie wordt 500.000 keer per jaar uitgevoerd in Europa, de Verenigde Staten en Japan samen (met jaarlijkse groei van 5%), om twee of meer ruggenwervels vast te zetten. Tot 35 procent van de patiënten heeft één jaar na de operatie nog altijd pijn. De huidige standaardprocedure bestaan erin de tussenwervel te vervangen door een kooi, gevuld met biokeramische granulen en autoloog bot uit de heup – een heel pijnlijke ingreep – al dan niet in combinatie met middelen die de beencelgroei moeten stimuleren (zoals BMP). Die middelen worden vooral in de Verenigde Staten gebruikt en hebben in het verleden tot ernstige veiligheidsproblemen geleid.
Bij negen van de vijftien patiënten in het onderzoek van Bone Therapeutics werd na twaalf maanden een wervelfusie vastgesteld en verbeterde de score op een invaliditeitsindex (Oswestry Disability Index) met 55 procent. Na 24 maanden steeg het aantal patiënten met een geslaagde wervelfusie tot dertien (86,7%). In de tweede cohort vertoonden dertien patiënten na twaalf maanden al een wervelfusie. Dat aanzienlijk betere resultaat is wellicht het gevolg van een betere dosering van biokeramische granulen in de tweede cohort.
Gecombineerd was er een succesvolle fusie bij 22 op 30 patiënten (73,3%) na twaalf maanden en een gemiddelde verbetering op de invaliteitsindex met 62,95 procent (van ernstige naar lage functionele beperking). De secundaire eindpunten scoorden sterk: een radiologisch vastgestelde onbeweeglijkheid van de wervels bij alle patiënten en een forse vermindering van de pijn in de rug (-67%) en de benen (-75%). De veiligheidsparameters scoorden ook goed. Professor Bronek sprak zich als belangrijke opinieleider die niet betrokken was bij de studie lovend uit over de resultaten en het potentieel van ALLOB.
Bone Therapeutics zal de volgende stap bespreken met de autoriteiten. De resultaten bieden een tweede proof-of-concept met ALLOB (naast traag helende beenbreuken) en effenen het pad voor bijkomende indicaties. Bone Therapeutics kondigde ook de benoeming van de Amerikaanse Gloria Matthews als onafhankelijk bestuurder aan. Matthews heeft zowel een stevige ervaring in celtherapie als in orthopedie. We zien haar benoeming als een vertrouwenwekkend signaal.
Voor eind 2019 dient Bone Therapeutics de aanvragen in in Europa en de Verenigde Staten voor de opstart van een fase II/III-studie met ALLOB (op basis van het nieuwe productieproces) bij patiënten met traag helende breuken en voor een fase III-studie met vicosupplement JTA-004 in knieartrose.
Toch steeg het aandeel per saldo niet na de bekendmaking van het positieve nieuws. Het ontbreken van een controlegroep in de kleinere studies met ALLOB speelt mogelijk een rol. De volgende, grotere studies zullen wel een controlegroep hebben. Maar vooral speelt de zwakke kaspositie (nog voldoende tot in het vierde kwartaal) en de converteerbare obligatie (vervaldatum september 2019).
Conclusie
We zijn heel tevreden met de resultaten en kijken uit naar nieuws over bijkomende financiering. We gaan ten gepaste tijde onze positie verder uitbreiden, gezien de uiterst lage beurswaarde voor een bedrijf dat begin 2020 twee fase III-studies zal opstarten. Er is geduld nodig, maar we zijn gesterkt in ons geloof in de slaagkansen van Bone Therapeutics. Het aandeel blijft koopwaardig (rating 1C).
Advies: koopwaardig
Risico: hoog
Rating: 1C
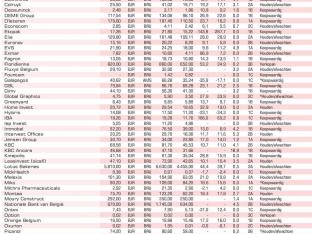
Koers: 4,46 euro
Ticker: BOTHE BB
ISIN-code: BE0974280126
Markt: Euronext Brussel
Beurskapitalisatie: 38,7 miljoen euro
Verwachte k/w 2018: –
Verwachte k/w 2019: –
Koersverschil 12 maanden: -62%
Koersverschil sinds jaarbegin: +0%
Dividendrendement: –
Aandelen België
Fout opgemerkt of meer nieuws? Meld het hier