De klok tikt voor Oxurion

Oxurion heeft twee aantrekkelijke kandidaat-geneesmiddelen die in 2023 mogelijk een belangrijke waarde kunnen realiseren. Intussen tikt de klok om extra financiering op te halen.
De komende twaalf maanden worden cruciaal voor het Leuvense biotechbedrijf Oxurion. Op 1 september werd de rekrutering aangekondigd van de eerste patiënt voor de fase II-studie met THR-149. Dat is de eerste van twee kandidaat-geneesmiddelen in een klinische ontwikkelingsfase waarmee Oxurion een belangrijke speler in diabetes gerelateerde oogziekten wil worden. THR-149 is een plasma-kallikreïneremmer voor de behandeling van patiënten met diabetisch macula-oedeem (DME), die eerder suboptimaal hebben gereageerd op de huidige standaardbehandeling met een anti-VEGF-middel (Lucentis en Eylea). Oxurion mikt met THR-149 op 40 procent van de patiënten die onvoldoende reageert op een anti-VEGF-behandeling.
De fase II-studie is opgezet in twee fasen. Het eerste deel is een doseringsstudie, waar telkens zes patiënten drie maandelijkse injecties van drie dosissen krijgen toegediend. De resultaten zullen midden 2021 bekend zijn. Het tweede deel is een vergelijkingsstudie, waar de beste dosis uit de eerste studiefase wordt vergeleken met aflibercept (Eylea), met verwachte resultaten in de eerste helft van 2023. Oxurion hoopt een snelle en aanzienlijke verbetering van de oogscherpte te kunnen aantonen, met een duurzaam effect van minstens drie maanden. In de fase I-studie realiseerde één injectie met THR-149 een gemiddelde verbetering na veertien dagen en drie maanden. Meerdere injecties zouden het effect moeten verhogen.
Na de positieve fase I-studieresultaten in januari met de integrineremmer THR-687 op DME-patiënten die eerder op een anti-VEGF-behandeling hebben gereageerd, lopen de voorbereidingen voor de start van een fase II-studie tegen midden 2021. Ook dat wordt een studie in twee delen, met verwachte resultaten van het doseringsdeel in de eerste helft van 2022 en volledige resultaten in 2023. Het toepassingsgebied van THR-687 is breder, zowel bij patiënten die nog niet zijn behandeld met een anti-VEGF-middel als patiënten die onvoldoende reageerden. Later kan het kandidaat-geneesmiddel mogelijk ook worden getest voor natte leeftijdsgebonden maculadegeneratie (natte AMD) en retinale veneuze occlusie (RVO). Oxurion versterkte begin augustus het managementteam met de benoeming van de Amerikaanse dokter Grace Chang tot chief medical officer. Chang is actief als oogchirurg en heeft veel ervaring met de ontwikkeling van ooggeneesmiddelen.
De komende twaalf maanden kijken we uit naar nieuws uit de preklinische onderzoeken naar mogelijke nieuwe behandelingen voor droge leeftijdsgebonden maculaire degeneratie (droge AMD). Daarnaast verwachten we nieuws van Oncurious, de spin-off gericht op kankerimmunologie, waarin Oxurion een belang van 85 procent heeft. Het is uitkijken naar een of meer preklinische proof-of-concepts in de vier onderzoeksprojecten. Dat kan de basis leggen voor een aparte financieringsronde van Oncurious volgend jaar, om de volgende stappen van het onderzoek te financieren. Intussen tikt de klok om extra financiering op te halen tot de uitlezing van de fase II-studies met THR-149 en THR-687 in 2023. Het bedrijf had op 30 juni nog 37,9 miljoen euro cash. Dat is voldoende tot midden 2021.
Conclusie
Oxurion heeft met THR-149 en THR-687 twee aantrekkelijke moleculen die in 2023 mogelijk een belangrijke waarde kunnen realiseren. Maar de koersevolutie blijft ontgoochelen. We vinden de verhouding tussen het risico en de mogelijke opbrengst nog altijd voldoende aantrekkelijk voor een koopadvies voor de risicobewuste biotechbelegger. De spoeling wordt wel dunner in het licht van de financieringsbehoefte in de komende kwartalen.
Advies: koopwaardig
Risico: hoog
Rating: 1C
Koers: 2,53 euro
Ticker: THR BB
ISIN-code: BE0974281132
Markt: Euronext Brussel
Beurskapitalisatie: 96,9 miljoen euro
K/w 2019: –
Verwachte k/w 2020: –
Koersverschil 12 maanden: -8%
Koersverschil sinds jaarbegin: -14%
Dividendrendement: –
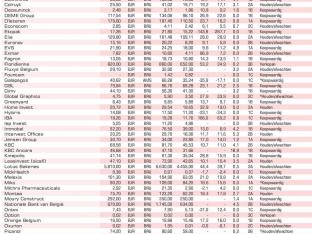
Aandelen België
Fout opgemerkt of meer nieuws? Meld het hier